■そうそう、私たちの思っている貧血は医学用語の貧血と違う。
ふとその事を思い出しました。
どちらかといえば造血における機序の一部喪失であったり障害が貧血といえます。
立ちくらみじゃないんだよ、という話です。
■今話題にしているフェリチンや、トランスフェリンが関わっているんですよね。
というか、既に複合被曝の話から逸れています(苦笑)
調べると、こんな面白いたんぱく質はないです。貧血の機序、鉄輸送の機序を考えると
実に面白い物だと思います。
■そうして、今光の当たりだした、そういう現在進行形の研究の進む物です。
12ナノのかごフェリチンが金属を吸込む様子が
2008年に京都大学を始めとするグループから発表されていたりと
これからも研究が進んでいくでしょう。
と言う訳で以下は、ディープな自己満足の世界。
今回は読まなくてもいいと思います。PDFばっかりですしね
■
がんと貧血
87年の札幌医大の先生の記述です。
癌と貧血が、近しい関係にあるという物です。原因としては一つは出血
もう一つには、リウマチやSLE(膠原病)などの炎症に絡む機序がある、という物です。
(但し急性反応期蛋白に伴うマクロファージの捕食反応のようです)
後は、赤血球寿命、骨髄造血機能の低下
後はがん細胞への蓄積でしょうか。がん細胞への蓄積は実に不思議な物です。
■もう一つ気になるのはトランスフェリンへの引渡し過程、
生物が重金属の害にさらされない為には、恐らくここで重金属を除く鉄だけが
トランスフェリンに遊離すると思っていますが、それはまた別の話になるでしょう。
生態系の鉄が半閉鎖系というのが面白い物だと思います。
そして余った鉄は改めてフェリチン内に溜まると。
そのように考えると金属を包み込むシュウマイの皮のようなもののようですね。
また酸性フェリチンと、塩基性フェリチンの違いは
この頃に発見されてきた物なのだという事がわかります。
癌については必ずしもではないが、
貧血が起きている場合は疑ってみる価値がある。
用途が多いだけに、フェリチンが絡む癌、絡まない癌があるということと受け取りました。
*********************************
■
胃平滑筋腫における高血清フェリチンの一例。
世の中には不思議な腫瘍があるものですね。
肝臓、膵臓、乳腺、子宮、副腎腫瘍に血清フェリチンが高くなる、この1行の為に登場しています。
乳がんも、放射線に応じて増える疑いのある癌です。
腫瘍フェリチンについて述べられていますね。
*****************************
■こちらは女子医さんの研究より(1987)
腫瘍マーカーの臨床応用について、ですね。
この頃はまだ腫瘍マーカーの臓器別の特異性探しが盛んだったのだと思います。
この後は徐々に、臓器独自の腫瘍マーカーが注目されていったようです。
H型つまりは酸性フェリチンといわれるものの方が重要だと言うのが興味深いです。
肝臓型のフェリチンは、肝臓破壊で出てきますから、
癌ではない、肝臓系の情報にかく乱されやすいのだと思います。
もちろん今でも、目安としては血清フェリチンも使われているのでしょうが、
その重要度は下がっていた物と思われます。
*********************
■こちらは
精巣腫瘍とフェリチンの値ですね。
隔清をした結果フェリチンが下がる場合もあり、下がらない場合もあり。
原因によって、腫瘍のフェリチンが高い場合もあり、低い場合もあり、という事なのでしょうか。
またH型フェリチンが心臓由来である為に、心臓や胎盤から産生され
(※胎盤からセシウム被曝が起きる可能性があるの「かも」しれない)
異常値が出たときにも、多臓器由来による陽性の可能性を検討する必要がある
とされています。
また、こちらでは膵臓、肝臓、肺がんに有効であり、腎癌、精巣腫瘍に有効と思われる、
となっています。
腫瘍マーカー黎明期において重要視されたが、万能ゆえに、関係ないことも多く
今は血液検査で、疑うきっかけとして使われている、というのが現状なのでしょうね。
***************************
■このようにフェリチンにも色々種類があり「イソフェリチン」と呼ばれています。
血清フェリチンも、大まかにはL型(肝臓、膵臓)、H型(酸性フェリチン)があり、
更に原因によっては「腫瘍フェリチン」が発生しうる、(主にH型)
とりあえずはセシウムがフェリチンによって吸着される可能性は高いと思う、と言う事は確かです。
気になるのがセシウム137の化合物はカリウムに似た振る舞いをすると言う事です。
とは言え、必要不可欠かつ、毒性のある鉄を安全に保持する仕組がフェリチンであるわけで
せしうむも恐らく細胞内でフェリチンに包まれるのではないかと言う過程は十分に成り立つのではないかと思っています。
******************
■もう一つ
モノクローナル抗体産生方法の特許と言うページを取り上げます。
面白いのは、
HELA細胞や胎盤におけるフェリチンが共通の物である事。
確かHELA細胞は未だに培養され続けている不死の細胞です。ヒーラ細胞であれば
有名ですので聞いたことがあるかもしれませんね。
これが、ヒトパピローマウイルスで不死化した、子宮頸がんの細胞と言うのですから
びっくりで、しかも染色体数は47より多いそうです。
■発癌プロセスの面白いのは、色々な原因でDNAが損傷する中で
あたかも違う細胞になってしまうこと、不死性を獲得する事、
未分化度が高いほど、悪性であること、等などありますが、
やはり
胎児の細胞に近い性質を持つと言うのは非常に面白い物です。
そして、「鉄」がその鍵を握るのです。
***********************
■最後に、
腫瘍マーカー がん胎児性抗原と言うページの引用をしておきたいと思います。
以下引用
腫瘍マーカーが実用化された当初は、
主に、がん胎児性抗原、CEA、AFP、β2ミクログロブリン、フェリチン、
が使われ、あとは、シアール酸が、腫瘍マーカーとして使われるケースも
ありました。 シアール酸は、基本的には、炎症マーカーという捉え方でしたが、
最近は、もう使わないようです。
これらの物質を精製するのに、産婦人科のある医療機関から、
後産、お産のあとの胎盤を集め、胎盤血を抜いて、胎盤は返却する
という作業が必要でした。 胎盤血の中に、こういった腫瘍マーカーとなる
物質が入っているのです。 胎盤血を診断薬用に使用してもいい県は、
全国で四つ位しかなかったと記憶しています。 しかも、使用後は、
ちゃんと、供養している、と聞いていました。 赤ちゃんが生まれたのに、
供養というのは、よく分からなかったですが。
CEAというのは、Carcino Embryonic Antigen 名前の通り、
腫瘍・胎児性・抗原です。 急成長する腫瘍組織では、がん細胞は、
正常細胞よりも、未分化な状態であり、かつ、盛んに増殖するという状態が
胎児の細胞に近いわけです。 そのためでしょうが、急成長中の腫瘍組織は
時々、胎児の細胞が沢山出す物質と同じものを出すことがあります。
代表格が、
CEAですが、AFP(アルファ・フェト・プロテイン)も、フェリチンも
名前にフェトとか、フェリとかあるように、フェラス、つまり鉄に関係する蛋白
です。急成長する組織は大量の鉄分を必要とするので、鉄を蓄える蛋白質を
沢山用意するのです。
引用終)
もちろん腫瘍マーカーで全ての癌が分かるかと言われれば大間違いです。
慣れているお医者さんが診たとき「気になるね」と精検に送るかどうかの話で、
よく、検査で何も出ていないのに見抜けないのはやぶ医者だとか、
検査で何が出ていたのに見逃したのはやぶ医者だとかいう話になりますが
大間違いです。
専門医の、経験(大抵はうまく行かなかった、転移が進んで亡くなった)がその判断を為すわけで
医学的には失敗でなくても治療的な失敗(死者)が、命を持って助かる助けをしているだけのことです。
ただ、おおかた半数近くの癌、それも乳がん、すい臓がん、肝臓、肺、白血病(骨髄系癌)
において、有意な腫瘍マーカーとしてフェリチンが作用すると言う事は、
とても意味深な事です。
フェリチンによる体内ホットスポット、この可能性は
逆にがん細胞には放射線治療になる可能性もあるわけです。
(フェリチンにラジウムを吸収させて、中から細胞を破壊する)
ラジウム泉に言われる健康効果は諸刃の剣と考えると、興味深くてなりません。
結局は
殺すがん細胞の数>がん化する細胞の数
このバランスを考えると
、「がん化するピーク」が人によって違うと言う事が予想され
それが
放射性物質によって、ピーク時期が左右される。
複合被曝はこのように考えれば良い物と思われます。
40以上の人間であれば、がん細胞に放射性物質が付着し、
20年後の発癌などと引き換えに、内部被曝でがん細胞を破壊する、
そういうことも起き得るかも知れません。
ところが
10代以下の若い年齢で被爆してしまえば、
30~50台に発癌のピークが一気に襲うと言う結果にもなりかねません。
ひょっとすると、
被曝が有意によい方向に働く人間、年齢が存在する可能性があります。
ただ、子供にはどう考えてもいい効果はないはずです。
また、胎児は鉄を必要とする為に、鉄と一緒に放射性物質を膨大に取り込む可能性があります。
だとすれば放射性物質が奇形に繋がる可能性は、一つの説明となりうるでしょう。
そこに
フェリチンを始めとするたんぱく質が絡んでいるとすれば、
天の配剤としか言いようがないのだなと思わざるを得ないです。
仮説ですけどね。そのあたりのデータは、福島でふんだんに取られる事となると思いますけれど。
************************************
モノクローナル抗体産生方法の特許
【構成】 ヒト腫瘍胎児性フェリチン抗原のエピトープと特異的に結合するがヒトの脾フェリチン抗原のエピトープ又はヒトの肝フェリチン抗原のエピトープとは結合しないモノクローナル抗体を産生するクローン、及びその製法。
【特許請求の範囲】
【請求項1】 ヒト胚フェリチン抗原と結合するがヒトの脾フェリチン抗原又はヒトの肝フェリチン抗原とは結合しないモノクローナル抗体を産生するクローン。
【請求項2】 ヒト腫瘍胎児性フェリチン抗原のエピトープと結合するがヒトの脾フェリチン抗原のエピトープ又はヒトの肝フェリチン抗原のエピトープとは結合しないモノクローナル抗体を産生するクローンの製法であって、(a) ヒト胎盤から誘導した胚フェリチンをヒト腫瘍胎児性及びヒト成人脾フェリチンの抗原上の共通の結合サイトと反応するモノクローナル抗体と反応させて、前記結合サイトを前記モノクローナル抗体との反応によりブロックしたフェリチンを形成し、(b) 動物に、工程(a) の反応生成物であるフェリチンを免疫接種し、(c) 前記した動物の感作リンパ球をミエローマ細胞とハイブリダイゼーションし、次いで(d) ヒト胚フェリチン抗原のエピトープと特異的に結合するがヒトの脾フェリチン抗原のエピトープ又はヒトの肝フェリチン抗原のエピトープとは結合しないモノクローナル抗体を産生するハイブリドーマクローンを選択することからなる前記クローンの製法。
【請求項3】 前記免疫接種が、完全フロイントアジュバント中の腫瘍胎児性フェリチンを用いる免疫接種の連続による請求項2に記載のクローンの製法。
【請求項4】 リンパ球とミエローマ細胞を20:1 ~ 1:1 の割合で用いる請求項2に記載のクローンの製法。
【請求項5】 前記割合が約10:1 である請求項4に記載のクローンの製法。
【請求項6】 免疫接種される動物がマウスである請求項2に記載のクローンの製法。
【請求項7】 マウスがBalb/c メスマウスである請求項6に記載のクローンの製法。
【発明の詳細な説明】【0001】本発明は、ヒト胎盤から取出されたヒト胚フェリチンと反応し成人の脾又は肝のフェリチンとは反応しないモノクローナル抗体、及びヒト胎盤の胚フェリチンと反応し成人脾フェリチンと交叉反応するモノクローナル抗体に係る。
【0002】本発明は更に、ヒト肺癌及び/又はホジキン氏病を発見するために、ヒト腫瘍胎児性フェリチンが存在しそうな体組織及び/又はリンパ球を患者から取出して選択的に定量するアッセイに係る。
【0003】本発明の特定具体例によれば、ヒト腫瘍胎児性フェリチンの有無が細胞障害アッセイによって判定される。
【0004】本発明の別の特定具体例によれば、ヒト腫瘍胎児性フェリチンの有無がラジオイムノアッセイによって判定される。
【0005】本発明のアッセイは、特異的モノクローナル抗体の使用に基く。該抗体は腫瘍胎児性フェリチンの有無を判定するのに適したいかなるタイプのアッセイにも使用することが可能である。該フェリチンの存在は、第1期もしくは第2期の肺癌(breast cancer) 又はホジキン氏病の指標とされる。
【0006】本発明の好ましい具体例によれば、患者の血流中のリンパ球の表面で腫瘍胎児性フェリチンの存在が判定され、このようなフェリチンの存在が肺癌又はホジキン氏病の指標とされる。
【0007】フェリチンは、主として組織に貯蔵された鉄タンパク質であり、血漿中で少量(65-150ng/ml) が検出され得る。正常組織のフェリチンを等電集束法(isoelectric focusing)で分析するとかなりの異質(heterogeneity) が見られる。MarcusとZimberg とは(Arch. Biochem. Biophysic. 162, 493, 1974)肺腫瘍組織から単離されたフェリチンが成人肝フェリチンには見られない酸性イソフェリチンを含有することを発表し、DrysdaleとSingerとは(Cancer Res. 44, 3352, 1974)Hela腫瘍細胞と胎盤細胞とに酸性イソフェリチンが存在することを発表した。彼等は、このようなイソフェリチンを“癌胎児性”イソフェリチンと指称し得ると考えた。
【0008】MarcusとZimberg(Clin. Res. 23, A447, 1975)及びJacobs他(Br. J. Cancer 34, 286, 1976) は、肺癌患者では血清のフェリチン濃度が増すことを報告し、フェリチンの定量が肺癌発見の指標となり得ると考えた。しかし乍ら、異質(heterologous)抗フェリチン血清は、成人フェリチンの抗原性決定因子及び癌胎児性フェリチンの抗原性決定因子の双方と交叉反応するので、これらの2種のイソフェリチンを判別することができない。従って、フェリチンレベルが正常範囲より高い(>200ng/ml) 患者の場合にのみ有意な結果が得られる。最近の研究ではMoroz 他が(Cancer Immunol. and Immunotherapy 3, 101, 1977),肺癌患者に於いて、表面にフェリチンを担うリンパ球のサブ集団を同定した。このフェリチンは癌胎児性フェリチンであり、これらのフェリチンが陽性のリンパ球は肺癌の初期(第1期~第2期)に現れる。このようなリンパ球は、良性の肺疾患の患者又は健康人では見られない(Giller 他,Surgery Gyn. Obst. 149, 655, 1979)。
【0009】リンパ球に付着したフェリチン又は組織液中に存在するフェリチンの同定が、病人の肺癌の早期発見用アッセイの基礎である。
【0010】近年、マウス骨髄腫細胞と超免疫マウス脾細胞とのハイブリッド形成方法が開発された(Kohler 及びMilstein, Nature, 256:495:1975) 。このようなハイブリッド細胞は、1個の抗原性決定因子にのみ対応する1個の抗体を生成し得る。このようなハイブリッド細胞をクローニングすると、1個のモノクローナル抗体を生成するハイブリッド細胞のクローンが得られる。癌胎児性フェリチンのみが有しており成人フェリチンが有していない1個の抗原性決定因子に対応するモノクローナル抗体を用いた成人の(血漿又はリンパ球での)イソフェリチンの同定は、悪性疾患を発見するためのより特異的でより感受性の高い手段となり得る。その結果、血清中の成人フェリチンの増加を生じる良性疾患が悪性疾患と診断されるエラーが少なくなる。
【0011】本発明は、夫々がヒト胎盤フェリチンの別個の抗原性決定因子に特異的な2種のマウスモノクローナル抗体の製造に係る。
【0012】1)ヒト胚フェリチンに特異的な抗原性決定因子に対応するCM-OF-H9。
【0013】2)ヒト胚フェリチン及び成人脾フェリチンに対する相互決定因子に対応するCM-OF-3。
【0014】本発明は更に、肺癌を早期発見するための感受性アッセイに係る。このアッセイは更に、ホジキン氏病をも発見し得る。肺癌の早期発見又はホジキン氏病の発見のために、血清中及び他の体液中に存在するか又はリンパ球に付着した“腫瘍胎児性”フェリチンの同定に基くテストが行なわれる。
【0015】モノクローナル抗体CM-OF-H9は腫瘍胎児性フェリチンにのみ特異性を有しているため、癌による血清フェリチンの増加と正常フェリチン又は良性疾患(例えば地中海貧血)によるフェリチンとを判別し得る。CM-OF-3は、両方の疾患によるフェリチンの増加を検出し得る。両方の抗体を用いたテストによって悪性疾患と悪性でない疾患とを判別し得る。
【0016】
【実施例】
腫瘍胎児性フェリチンの調製Beawish 他の方法(J. Clin. Path. 24, 581, 1971)を変形してヒト胎盤からフェリチンを調製した。胎盤組織(500gr) を薄切りし、全容2000mlになるまで水を添加した。組織懸濁液を均質化し、75℃で20分間加熱した。冷却し10,000rpm で15分間遠心分離して得た上清を酢酸で処理してpH4.6 にした。10,000rpm で15分間遠心分離して沈殿タンパク質を除去し透明な上清を希NaOH中性pHに調整した。透明な褐色上清を100,000 gで240 分間超遠心し、懸濁フェリチンを管底部に小粒として収集した。沈殿物を0.9 %食塩水溶液に再溶解し、更にセファデックスSephadex G 200カラムに通して精製した。このカラムより得たフェリチン画分を、pH7.5 、濃度勾配0.02~0.5 Mのトリス-HClバッファを用いDEAEセルロースアニオン交換樹脂に通した。3個のタンパクピークが生じた。最も酸性のピークpI=4.8 (No. III)を収集して分析した。等電集束法と、抗フェリチン血清及び抗ヒト全血清に対する免疫電気泳動法とによって純度を測定した。得られたフェリチンを下記の如くマウスに免疫接種した。
【0017】ハイブリドーマの調製骨髄腫細胞ハイブリッド形成用の骨髄腫細胞PB/NS1/1-Ag4-1を20%胎児性仔牛血清(FCS)を含むRPMI-1640中で増殖させた。
【0018】マウスBalb/cメス、テスト開始時に生後4-6週。
【0019】免疫プロトコル-完全フロインド補助液中の酸性フェリチン50μg を週1回の割合で3回接種し最後にフェリチン10μg を注射して3日後にハイブリッド形成を行なう。少くとも1カ月経過後に超免疫マウスに最終的なブースター注射を行なう。
【0020】細胞調製脾細胞a.マウスの脾をRPMI-Oに取出す。
【0021】b.ペトリ皿でRPMI-Oで2回洗う。
【0022】c.18ゲージの針を用いRPMI-O中で切開する。
【0023】d.細胞懸濁液を試験管に移し、多量の組織を沈殿させる。
【0024】e.セル懸濁液を新しい管に移し、800rpm(160xg) で5分間回転させる。
【0025】赤血球をpH7.5 の0.83%NH4 Clで溶解する。
【0026】f.細胞をRPMI-Oで3回洗浄し、RPMI-Oに再び懸濁させる。
【0027】g.トリパンブルーTrypan Blue で細胞をカウントする。
【0028】骨髄腫細胞a.培養フラスコの細胞を50mlのファルコンFalcon/コーニングCorning 管にピペットで静かに移す。
【0029】b.900rpm(200xg) で5分間回転させる。
【0030】c.RPMI-Oで1回洗浄し、RPMIに再び懸濁させトリパンブルーでカウントする。
【0031】脾細胞-骨髄腫細胞の結合a.50ml円錐形ファルコン/コーニング使い捨て遠心管で脾細胞と骨髄腫細胞とを10:1で結合した。
【0032】b.900rpm(200xg) で5分間回転し細胞をペレット化した。
【0033】c.培地をできるだけ完全に吸引した。
【0034】d.以後の溶液及び培地は全て室温で使用された。
【0035】細胞ペレットを入れた管を37℃の浴に浸漬し、穏やかに撹拌し乍ら0.2ml の33%PEG1500を1分間で添加し、200 gで5分間遠心する。細胞を再び懸濁させ、1分間穏やかに撹拌し、次に穏やかに撹拌しつつ5mlのRPMI-Oを添加し、20%胎児性仔牛血清(FCS)を含む5mlのRPMI-Oを添加した。このときに、ハイブリッド混合物は僅かに再懸濁し多数の小擬集塊を含む細胞懸濁液の状態であった。
【0036】e.混合物を200xg で5分間回転してペレット化した。
【0037】f.濃度3×106 /ccのRPMI-HY-HATD(37℃)に細胞を入れ細胞ペレットに培地をかけ乍ら再び懸濁させた。
【0038】g.5mlのピペットから細胞懸濁液を2滴添加するか又は(約65マイクロリットルの)カットオフチップを用いたマルチピペッタによって、96個のウェルプレートの平底に100-120 RPMI-HY-HATD(約2×105 細胞)を含むハイブリッドを塗抹した。
【0039】h.1×106 /mlでNS-1細胞+RPMY-HY-HATDを含む対照ウェルを用意した。
【0040】i.プレートを7日間培養した。
【0041】j.8日目及び以後週に2回の割合で培地を慎重に吸引して除去し、80-100 マイクロリットルのRPMI-HY-HT培地を補給した。
【0042】k.ハイブリッド形成の3及び4週後に陽性のウェルをスクリーニングした。
【0043】培地及び溶液1.RPMI-O(FCSを含まない)
2.RPMI 1640-HY500ML の無菌蒸留水55mlの10倍RPMI-16406mlの1.0 Nの水酸化ナトリウム14mlの7.5 %重炭酸ナトリウム6mlのPen/Strep +DMEM10mlのグルタミン+DMEM86.5mlのFCS+DMEM3.RPMI-HY-HA TD 0日目→7日目培地10ml当り95mlのRPMI-1640+20%FCS1.0ml の焦性ブドー酸塩(100倍)
2.0ml の50倍HAT2.0ml の50倍デオキシシチジン4.RPMI-HY-HT 8日目→14日目培地100ml 当り97mlのRPMI-1640+20%FCS2.0ml の50倍HT1.0ml の焦性ブドー酸塩(100倍)
15日目以後のハイブリッドに対してはRPMI-1640+20%FCSと焦性ブドー酸塩とを使用するか、又はRPMI-HY-HT中に維持する。
【0044】5.PEG33及び25重量/容量%無臭白色でなければならない。100ml オートクレーブに対し適量(重量グラム)をガラスびんに入れ15 lbsにして10~15分間維持する。びんが手で持てる程度(約50℃)に冷えると、RPMI1640-0を添加して100ml にし、振って混合し、RTで貯蔵する。
【0045】6.HATD-試薬の最終濃度H=ヒポキサンチン 10-4MA=アミノプテリン 10-6MT=チミジン 2×10-5MD=デオキシシチジン 2×10-6MHT原液の100 倍溶液-100ccチミジン M. Wt. 242.33-0.04846 gヒポキサンチン M.Wt. 136.1-0.1361g100ml まで dd H2 Oを添加し60-70℃に加熱して溶解する。 dd H2 Oを添加して最終量を再調整する。50倍に希釈しフィルタ(0.2μ)殺菌する。2mlずつのサンプルに分け-20℃で貯蔵する。
【0046】A原液の1000倍溶液-100ccアミノプテリン M. Wt. 440.4-0.44 gdd H2 Oを添加して50mlにしアミノプテリンが溶解するまで 0.1NのNaOHを滴下する。
【0047】dd H2 Oを添加して最終量を100ml にする。調製量100ml をフィルタ(0.2μ)殺菌し、-20℃で貯蔵する。
【0048】D原液の100 倍溶液-100ccデオキシシチジン M. Wt. 227.2-0.00454gdd H2 Oに溶解し、100cc に調製し原液の50倍に希釈し、フィルタ(0.2μ)殺菌し、-20℃で貯蔵する。
【0049】HATの50倍液-200ml100 倍HT100ml と1000倍A10ml+ dd H2 O90mlとを合せて50倍HATを調製し、フィルタ(0.2μ)殺菌し、2mlずつのサンプルに分け、-20℃で冷凍する。
【0050】血液凝集テストによってモノクローナル抗体の特異性のスクリーニングと定量とを実施した。胚胎盤フェリチン及び成人脾フェリチンをCrCl2 よってOx赤血球(OxRBC)に結合した。
【0051】(1:10から初めて)ハイブリードーマ培地の希釈度を増していき、該培地の上清50μlを10μlの成人又は胚フェリチンOxRBCと混合し、血液凝集を定量した。
【0052】少くとも1:1000の血液凝集素価を与えるクローンの上清を選択した。
【0053】選択クローンをCM-OF-3と指称する。
【0054】クローンCM-OF-3は胚フェリチンに特異的で成人フェリチン及び胚フェリチンの双方と交叉反応する。
【0055】得られたモノクローナル抗体CM-OF-3を使用し、胎児性フェリチンと成人フェリチンとの交叉反応決定因子を阻害して、胎児性決定因子のみに特異的に対応する別のモノクローナル抗体CM-OF-H9を生成した。
【0056】下記の免疫接種プロセスを使用した。
【0057】A.免疫接種及び融合プロトコルヒト胎盤から単離した胚フェリチン即ちPI 4.8のタンパク質(前記参照)を下記の割合でモノクローナル抗体CM-OF-3と反応させた。胚フェリチン(PBS中90μg )を抗フェリチンモノクローナル抗体CM-OF-3(10mgr /ml)を含むBALB/cマウスの腹水液と混合した。
【0058】混合物を37℃で30分間インキュベートし、次いで4℃で1晩インキュベートした。混合物を10000 G遠心し、形成された沈殿物を廃棄し、上清を用いて免疫接種を実施した。前記上清を完全フロインド補助液と混合し、週1回の皮内注射を3回実施して各BALB/cマウスに免疫を与えた。プースターとして、前記の1/5の用量を腹腔内に注射した。
【0059】プースター注射の3日後、マウスの脾を無菌的に取出して、前記のハイブリッド形成プロセスに従い108 の脾細胞を107 のP3-NSI/1-Ag4骨髄腫細胞と共にインキュベートして融合を生起し、以後も前記プロセスに準じて処理して陽性のクローンを固定した。得られたクローンをCM-OF-H9と指称する。
【0060】B.得られたモノクローナル抗体の定性モノクローナル抗体CM-OF-H9は下記の特性を有する。
【0061】IgGのグループに属する。フェリチンと共に沈殿物を形成しない。ラビット補体と結合する。得られた腹水液中の抗体含量は約7mg/mlであった。1mlの腹水液は約2mlの胚フェリチンと結合するが、成人の脾又は肝のフェリチンとは結合しない。
【0062】
モノクローナル抗体の反応性 ヒトフェリチンの起源 CM-OH-H9 CM-OF-3 1.地中海貧血の成人脾 - +2.正常血清 - +3.肺癌(PBL)* + +4.肺癌(血清) + +5.ホジキン氏患者(脾) + +6.良性肺疾患(PBL)* - -7.良性肺疾患(血清) - + * PBL : 未梢血リンパ球2種の抗体によって、肺癌とホジキン氏病とを迅速且つ適切に発見し、更に、これらの病気と、やはりフェリチンの増加を生じる地中海貧血とを判別することが可能である。
【0063】血清学的テストプロセスの原理リンパ球付着フェリチン(LBF)の定量リンパ球付着フェリチン(lynphocyte bound ferritin )は、患者の肺癌の存在の指標となる。
【0064】前記の如きフェリチンは下記の如く定量される。
【0065】a.リンパ球を未梢血から単離する。
【0066】b.ヒト胎盤から誘導されたフェリチンに特異的な新規な特異的モノクローナル抗体を使用し従来同様のアッセイによってリンパ球付着フェリチンを定量する。
【0067】テストを下記の如く実施するのが好ましい。
【0068】a.Ficoll-Hypaque濃度勾配遠心法によって未梢血からリンパ球を単離する。
【0069】b.従来のアッセイ、例えば細胞障害テスト又はラジオイムノアッセイによってLBFの有無を検査する。
【0070】血清又は他の体液を用いて前記の如きアッセイを実施することも可能である。
【0071】肺癌及びホジキン氏病の早期発見用テスト細胞の収集と調製1.ヘパリンを入れた15mlの採血管。
【0072】2.25mlの円錐形遠心管。
【0073】3.パスツールピペット及びバルブ。
【0074】4.pH7.2 のPBS(燐酸ナトリウム緩衝食塩水)。
【0075】5.Ficoll-Hypaque濃溶液1.077gm /ml。
【0076】細胞の収集プロセス1.ヘパリンを入れた採血管に血液15mlを採取しpH7.2 のPBSで1:2に希釈する。
【0077】2.細胞懸濁液の下層に10mlのFicoll-Hypaque濃溶液を入れる。
【0078】3.室温で300xg で30分間遠心する。
【0079】4.Ficoll-Hypaque:培地の界面からパスツールピペットで単核細胞を収集し、新しい15mlの管に移す。
【0080】5.15mlのウォッシュ培地に懸濁させてセルの洗浄を3回繰返し、4℃で300xgの遠心を10分間行なう。
【0081】6.ウォッシュ培地に再び懸濁させて細胞数をカウントする。
【0082】ラジオイムノアッセイ(RIA)付加的所要材料1.100 ×15mmのミニソープMinisorp試験管2.RPMI 16403.ナトリウムアジド0.025 %含有のpH7.2 のPBS中のウシ血清アルブミン(BSA)5%4.正常ラビット血清(NRS)
5.CMH-9モノクローナル抗体6.白色腹水液7.125 Iの抗マウスIgGラジオイムノアッセイ-1Ficoll-Hypaque濃度勾配遠心によって未梢血単核細胞を単離する。
【0083】3組のテストを実施する。
【0084】A 対照 B テスト1.6個の試験管の夫々に2×106 ~3×106 の細胞を分け入れ、300gで10分間遠心して細胞をペレット化する。
【0085】2.PBSで1:10に希釈したNRS20μl を添加し、4℃で60分間インキュベートする。
【0086】3.3個の試験管の夫々に(5%BSAで10-5に希釈した)腹水液30μl を添加する。
【0087】A 腫瘍胎児性フェリチンと反応しない非特異的モノクローナル抗体IgG1 を含む対照腹水液B CMH-9モノクローナル抗体十分に混合して室温で2時間インキュベートする。
【0088】4.10mlのRPMI-1640と共に4℃で300gの遠心を10分間行なって細胞を2回洗浄する。
【0089】5.0.1 μCiのI125 ラビット抗マウスIgG(125-IラビットIgG 1μCi/μg )を添加し、4℃で60分間インキュベートし、冷たいRPMI-1640で4同様に2回洗浄し、放射能をカウントする。
【0090】陽性テストCpmA-CpmB<500ラジオイムノアッセイ-2RIA-1の段階1の処理後に下記のプロセスでテストする。Utsumi及びKarush(Biochem. 1965 4, 1766 )の方法に従ってCMH-9をペプシン消化してCMH-9のF(ab)2 を得、同様に非特異的IgG1 (RIA-1の対照)のF(ab)2 を得る。これらのF(ab)2 断片を下記の如く使用する。
【0091】試験管A:0.025 %のナトリウムアジドを含むpH7.2 のPBS中の5%BSA中の対照F(ab)2 。
【0092】試験管B:0.025 %のナトリウムアジドを含むpH7.2 のPBS中の5%BSA中のCMH-9F(ab)2 。
【0093】室温で60分間インキュベートし、pH7.2 のPBS中の1%のBSA2mlで1回洗浄する。
【0094】試験管A,Bに125 I-ラベル付き配位子を添加する(約105 cpm を与える)。配位子は、125 I-ラベル付き腫瘍胎児性フェリチン又は125 I-ポリクロナル抗腫瘍胎児性フェリチンと腫瘍胎児性フェリチンとの複合体である。抗原/抗体モル比1:1又は1:2までの複合体を調製し、室温で1時間夫々プレインキュベートする。ラベル付き配位子を細胞と共に室温で1時間インキュベートし、pH7.2 のPBS中の1%BSAで2回洗浄し、未結合のラベル付き配位子を取出してカウントする。BがAより多いとテストが陽性である。
【0095】細胞障害アッセイ2組のテストを実施する。
【0096】A 対照 B テスト1.濃度5×106 細胞/mlでPBLをRPMI-1640に懸濁させる。
【0097】2.12×75mmの試験管4本にPBLを150 μl ずつ入れ、(希釈度10-4の)腹水液(30μl )を添加する。
【0098】A 対照腹水液 B CMH-9Aを入れた試験管2本とBを入れた試験管2本とを4℃で45分間インキュベートする。
【0099】3.ラビット補体を添加し(PBSで1:5に希釈して100 μl )、穏やかに攪拌し乍ら37℃で60分間インキュベートする。
【0100】4.トリパンブルーで生細胞をカウントする。
【0101】陽性テスト:=Aの生細胞数-Bの生細胞数/Aの生細胞数×100 →4%細胞障害テストキット1.モノクローナル抗体CMH-92.非特異的モノクローナル抗体3.ラビット補体4.標準溶液中の従来のアジュバントPIAテストキット1.CMH-9のF(ab)22.非特異的モノクロナルのF(ab)23. 125I-ラベル付配位子RIA-1テストキット1.モノクローナル抗体CMH-92.非特異的モノクローナル抗体3. 125I-抗マウスIgG14.アジュバント及び標準溶液
【出願人】 【識別番号】592052656
【氏名又は名称】チヤヤ・モロズ
【出願日】 昭和57年(1982)5月14日
【代理人】 【弁理士】
【氏名又は名称】川口 義雄
【公開番号】 特開平5-260990
【公開日】 平成5年(1993)10月12日
 鉄と貧血【血清フェリチン探求続き】
鉄と貧血【血清フェリチン探求続き】  アスベスト小体について
アスベスト小体について 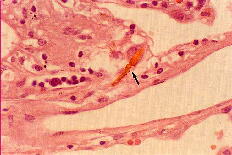

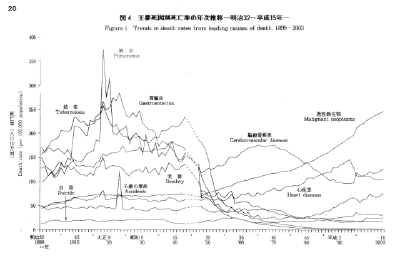
 【これぞ統計マジック】放射能と健康【危ないのは本当】
【これぞ統計マジック】放射能と健康【危ないのは本当】 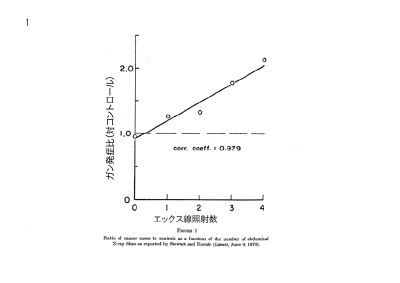
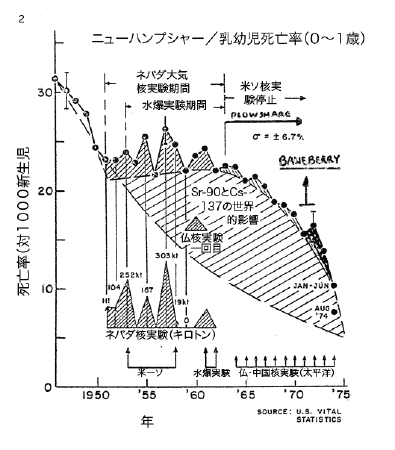
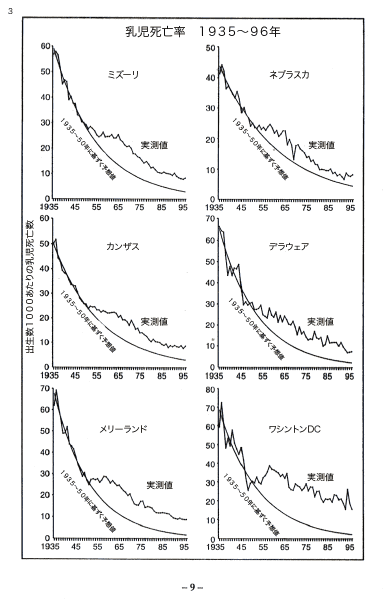
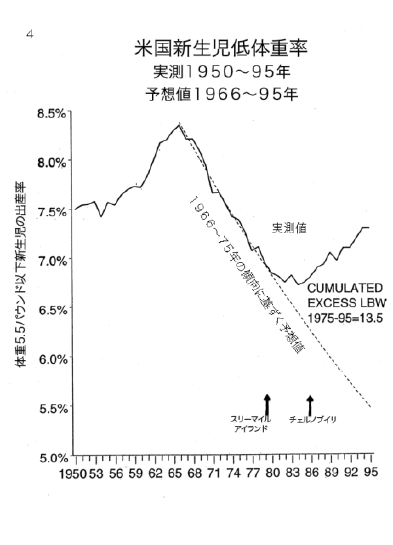
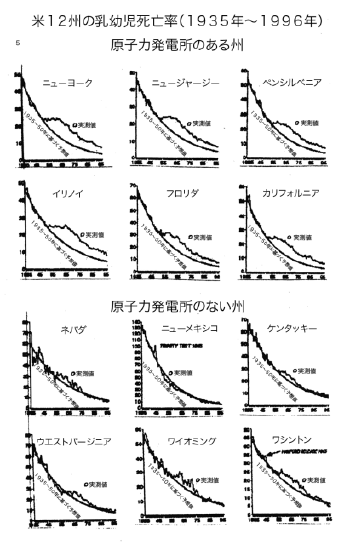
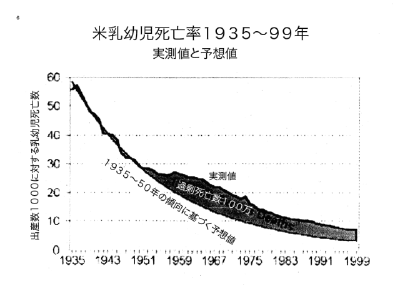
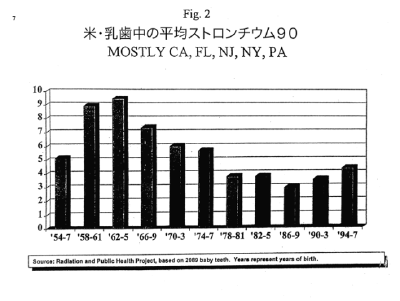
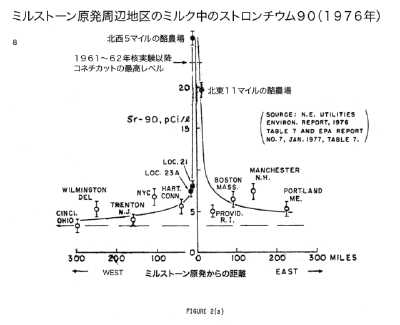

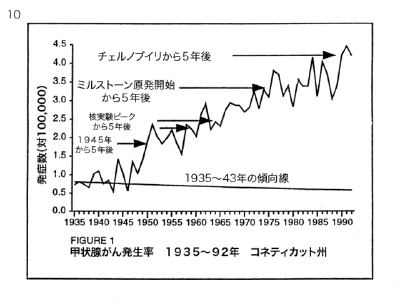
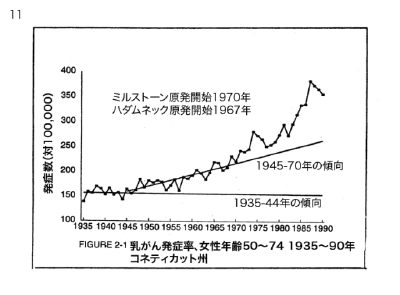
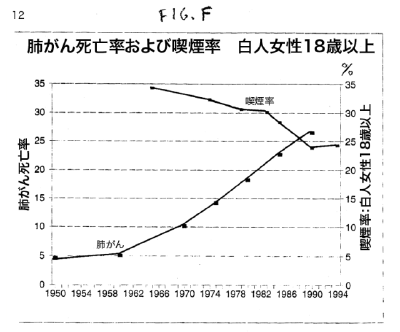
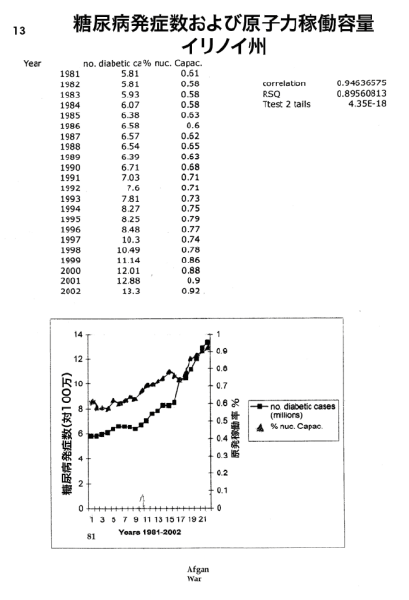
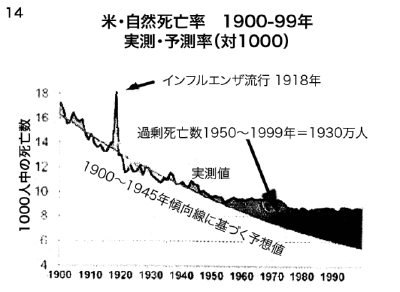
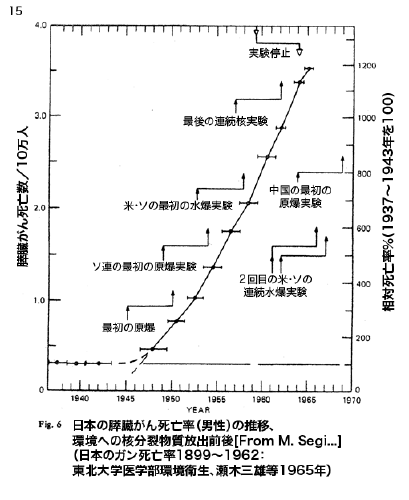
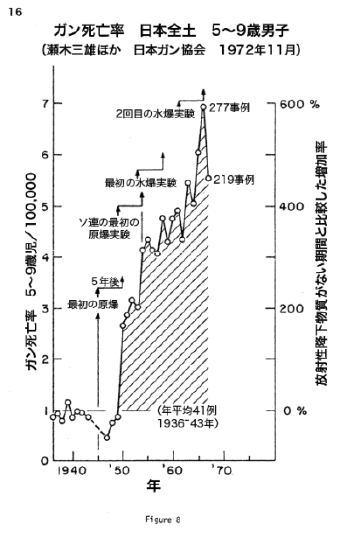
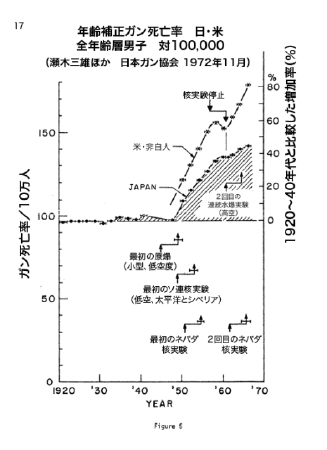
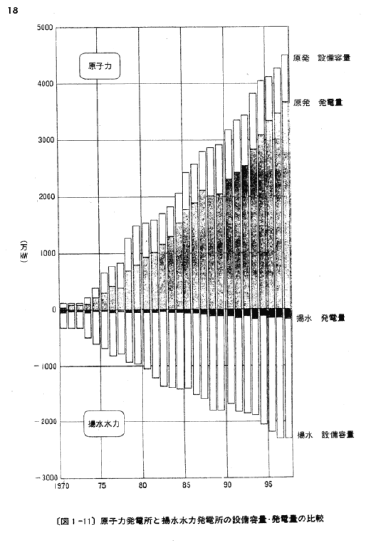
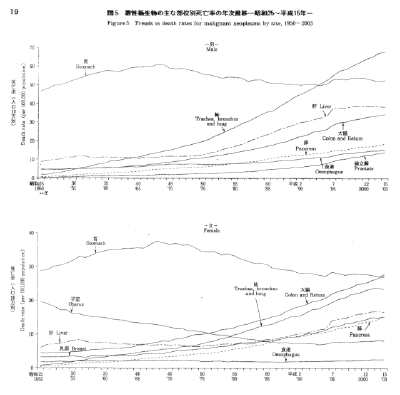


 【何者】フェリチンを探れ!【不可欠】
【何者】フェリチンを探れ!【不可欠】  ■中皮腫において、
■中皮腫において、




 【よく見ると】フェリチンへの放射性物質の沈着【あった】
【よく見ると】フェリチンへの放射性物質の沈着【あった】  ■岡山大学のデータをよーく見ますと
■岡山大学のデータをよーく見ますと



